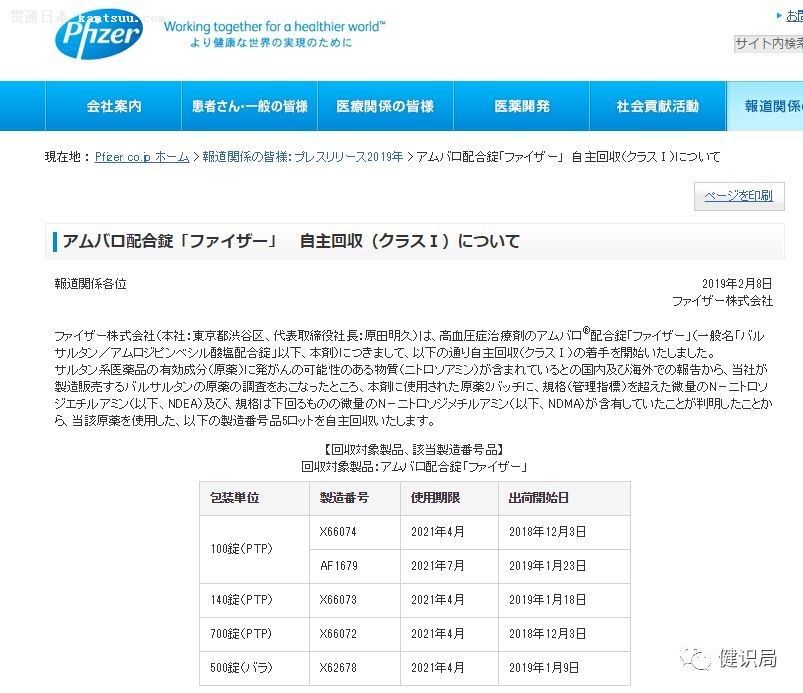
作者:雷公 “缬沙坦风波”正在向全球蔓延。 2月8日,辉瑞日本分公司表示,因缬沙坦原料药含有可能致癌的杂质,目前正在从日本召回4批次超26万片降压药Amubaro,召回行动已于上周四开始。
据健识君了解,此次被召回的26万粒药片是缬沙坦和苯磺酸氨氯地平盐的复方制剂,于2018年4月至7月在印度Mylan Laboratories Limited生产。 辉瑞表示,由于有报告称缬沙坦受到污染,因此对其产品进行了调查,发现该产品含有超标的N-亚硝基二乙胺(NDEA)及微量的N-亚硝基二甲基胺(NDMA)。 依照国际癌症研究机构(IARC)列出的致癌物清单,NDMA和NDEA均属于2A类致癌物(即动物实验证据充分,人体可能致癌但证据有限)。 分析人士指出,虽然在研究中发现NDMA 可增加癌症的发生率,但该杂质对人体的致癌性影响尚无充分数据支持。 辉瑞日本分公司总裁原田明久(AkiHisa Harada)在一份声明中说道:“我们真诚地为给患者和医护人员带来的不便和担忧表示诚挚的歉意。我们将密切关注药品的生产和质量控制,以防止复发。” 同时,辉瑞在此次声明中,目前还没有任何关于该药品对健康造成损害的报告。 不可否认的是,缬沙坦的召回事件继续扩大,已波及到全球市场。 从2018年起,华海药业在自查中发现,其生产的缬沙坦原料药中检测出NDMA与NDEA后,作为常见的降压药物,全球众多制药企业也纷纷受到波及。 2018年7月,诺华集团旗下山德士被曝正在召回其已销往22国的缬沙坦相关制剂,原因是来自外部供应商的成分含有杂质 2018年11月,Mylan制药开始召回其在印度生产的含有缬沙坦原料药的药品,并召回了15批含有NDEA超过批准水平的缬沙坦原料药。随后,Teva公司召回了所有使用Mylan受污染的原料药生产的缬沙坦药物。 2019年1月,印度仿制药公司阿拉宾度制药(Aurobindo Pharma)将召回80多批次的降压药物缬沙坦,这些药物被发现可能含有致癌杂质。 据健识君不完全统计,除了辉瑞外,包括诺华山德士、阿拉宾度、Teva等药企纷纷召回了自己的缬沙坦制剂产品。 曾有药企人士向媒体透露,由于出现了大面积召回,目前欧美市场上的缬沙坦制剂产品已经出现了一定程度上的短缺。 FDA曾在今年1月底的声明中表示,由于杂质的风险通常非常小,患者应继续服用药物,“直到他们的药剂师提供替代品或他们的医生提供替代治疗选择。” 首都医科大学附属北京世纪坛医院药剂科副主任药师金锐在接受媒体采访时表示,缬沙坦召回事件也是由于采用了新制订的NDMA和NDEA限量标准而触发的,实际上是一种进步。普通老百姓没必要因国外的降压药召回事件过于恐慌。如果国内产品有新问题出现,国家药监局和国内药品生产企业有能力进行质量管控和应急处置。 |
缬沙坦风波持续 辉瑞在日本召回大批降压药
新闻录入:贯通日本语 责任编辑:贯通日本语
相关文章
日本又有5人接种疫苗后现严重过敏反应 均为女性
日本逾4.6万人接种新冠疫苗 3人出现严重过敏反应
日本报告第三例接种疫苗过敏反应 仍在住院观察
日本又有5人接种疫苗后现严重过敏反应 均为女性
日本逾4.6万人接种新冠疫苗 3人出现严重过敏反应
日本报告第三例接种疫苗过敏反应 仍在住院观察
日本医疗人员接种辉瑞疫苗 出现第2例过敏反应
辉瑞新冠疫苗正式得到日本厚生劳动省批准
首批辉瑞新冠疫苗运抵日本 医务人员将率先接种
日本厚生劳动省称将予以辉瑞疫苗“特例批准”
首批40万剂辉瑞疫苗运抵日本 预计下周接种
日本官员证实:欧盟核准出口日本的第一批新冠疫苗
日本政府为全国民买单,1.44亿份疫苗最快2月开始接种
疫苗来了!日本抗击新冠疫情最后的希望?
日本单日新增新冠病例再创新高 拟采购英美药企疫苗
辉瑞在日本召回四批次降压药:召回不涉及中国市场
缬沙坦风波又起: 辉瑞在日本召回四批次降压药 公司称不涉及中国市场
缬沙坦风波又起:辉瑞在日本召回四批次降压药
陷足缬沙坦致癌风波 辉瑞日本公司召回相关降压药
缬沙坦"黑天鹅"波及全球 辉瑞在日本召回缬沙坦药物
综述:日本加强对医药行业潜规则监管
辉瑞戒烟药在日本断货
辉瑞可能不久将售出日本研发中心